藥品審評體系將生變,中國正發力在這一新領域補足短板
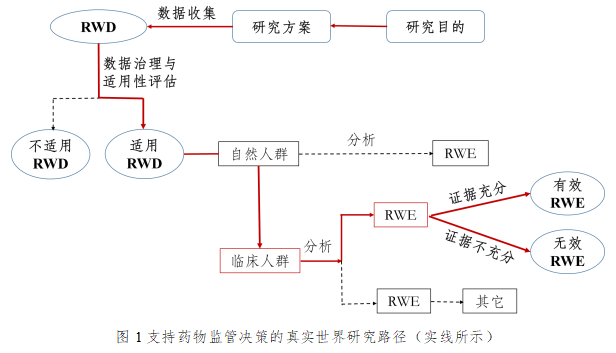
真實世界證據可用于支持藥物監管決策,包括為新藥注冊上市提供有效性和安全性證據、為已上市藥物的說明書變更提供證據、為藥物上市后要求或再評價提供證據等。我國特有的名老中醫經驗方、中藥醫療機構制劑的人用經驗總結與臨床研發,都可以成為真實世界證據的適用范圍。
每經記者 周程程每經編輯 陳旭
一種新藥研發過程中,到底如何才能證實它是否具有療效?或者是否具有毒副作用?雖然生病后打針吃藥是我們每個人都不陌生的事情,但可能很少有人會想到這樣一個“刁鉆”的問題。
不過1月7日國家藥監局發布了2020年的第一號通告,卻為我們揭開了藥物研發與審評這一領域神秘面紗的一角。
根據這一通告,“隨機對照試驗”這一實施半個多世紀、在新藥研發領域被視為圭臬的標準,可能將遭遇重大的變化——雖然從該標準1948年首次實施以來已經超過半個多世紀,并被藥物臨床研究所普遍采用,但由于它也具有一定的局限性,因此也需要其他的模式來進行補充和完善。而如今,“真實世界證據”這一新的模式正在肩負起上述使命,而我國因為在該領域涉足較晚,也開始發力補足相關的短板。
那么,什么是隨機對照試驗?什么又是真實世界證據呢?
藥監局1號通告支持真實世界研究
1月7日,國家藥監局發布《關于發布真實世界證據支持藥物研發與審評的指導原則(試行)的通告(2020年第1號)》(以下簡稱《指導原則》)。
圖片來源:國家藥監局
隨機對照臨床試驗(RCT)一般被認為是評價藥物安全性和有效性的金標準,但其研究結論外推于臨床實際應用時,可能會面臨挑戰,或者存在傳統的藥物臨床試驗可能難以實施及需要高昂的時間成本等問題。
而真實世界證據能夠彌補其不足,近年來越來越受到廣泛關注。真實世界證據是指來源于日常所收集的各種與患者健康狀況/或診療及保健有關的數據,經過分析后滿足適用性的有可能產生真實世界證據。
從其他國家經驗來看,真實世界證據在藥物研發與審批等方面發揮越來越重要的作用。《每日經濟新聞》記者注意到,此次我國《指導原則》中明確了真實世界證據的六大應用范圍,其中包括名老中醫經驗方、中藥醫療機構制劑的人用經驗總結與臨床研發等。
接受《每日經濟新聞》記者采訪的多位醫藥行業人士指出,真實世界證據可加快中藥新藥注冊的臨床研究,這對有效性和安全性有保障的中藥帶來利好。此外,真實世界證據數據全球范圍內都面臨著數據的質量與應用問題,中國應加快補齊這方面短板。
指導原則明確六大應用范圍
真實世界證據與傳統RCT提供的證據均可以是藥物監管決策證據的組成部分,支持監管決策形成綜合、完整而嚴謹的證據鏈,從而提高藥物研發和監管的科學性和效率。
近幾年來,真實世界研究逐漸成為國際認可的藥物研發及測試療效和安全性的新路徑。2015年,英國提出希望在2020年真實世界研究可以更廣泛地應用于藥品研發、審批、適應證調整等方面,美國也在2016年底頒布《21世紀治療法案》,旨在將真實世界研究納入現有的產品審批和監管程序中。

圖片來源:新華社
我國在真實世界證據方面的研究步伐也在加快。2019年5月,中國藥品監督管理局藥品審評中心發布了《真實世界證據支持藥物研發的基本考慮(征求意見稿)》(以下簡稱“征求意見稿”),此舉引起國內外藥企高度關注,翹首期盼文件的出臺。
例如,博濟醫藥在2019年半年報中就指出,該征求意見稿指出,利用真實世界證據用以評價藥物的有效性和安全性成為可能的一種策略和路徑。該意見定位于支持藥物研發,旨在厘清藥物研發中真實世界研究的相關定義,明確真實世界證據在藥物研發中的地位和適用范圍,探究真實世界證據的評價原則,以期為工業界利用真實世界證據支持藥物研發提供科學可行的指導意見。
《每日經濟新聞》注意到,經過了廣泛征求意見,并聽取工業界和臨床專家等各有關方的意見后,此次發布的《指導原則》中明確的真實世界證據的適用范圍為:新藥注冊上市提供有效性和安全性證據、為已上市藥物的說明書變更提供證據、為藥物上市后要求或再評價提供證據、名老中醫經驗方和中藥醫療機構制劑的人用經驗總結與臨床研發,以及指導臨床研究設計、精準定位目標人群等范圍。
有行業分析人士接受《每日經濟新聞》記者采訪時表示,真實世界數據對新藥新適應癥的拓展,同時對真實世界中患者的實際效果,也將是很好的驗證。
例如2015年,美國曾啟動阿司匹林的真實世界研究。阿司匹林是心臟病預防用藥,但一直缺乏最佳用藥劑量的科學依據。這項研究計劃將2萬名住院患者隨機分為兩組,分別使用兩種阿司匹林劑量,觀察預防效果,從而判斷出最佳用藥劑量。
中藥新藥注冊臨床研究有望提速
中醫藥行業一直十分關注真實世界證據。由于符合中醫特點的評價體系缺失等問題,許多中藥上市卡在臨床數據關口。此外,一些療效好的中藥院內制劑,由于是屬于中藥處方權的一種延伸,未通過藥監審批上市,沒有批準文號,多在醫院內使用。
針對我國特有的名老中醫經驗方、中藥醫療機構制劑的人用經驗總結與臨床研發,《指導原則》提出了采用真實世界研究與隨機臨床試驗相結合的研發策略,為此類中藥的評價提供了參考。
同時,《指導原則》提出,應用真實世界證據支持已有人用經驗中藥的臨床研發策略可以有多種,應根據產品的特點、臨床應用情況以及數據適用性等方面的考慮,選擇不同的研發策略。
例如可以探索將觀察性研究(包括回顧性和前瞻性)代替常規臨床研發中I期和/或II期臨床試驗,用于初步探索臨床療效和安全性;在觀察性研究的基礎上,再通過RCT或實用臨床試驗進一步確證已有人用經驗中藥的有效性,為產品的注冊上市提供支持證據。
如果經過評價,存在適用的高質量真實世界數據,且通過設計良好的觀察性研究形成的真實世界證據科學充分,也可與藥品監管部門溝通,申請直接作為支持產品上市的依據。
對此,上述行業分析人士指出,從《指導原則》表述上來看,可能更多在于減免一期、二期臨床實驗,但這也有利于在一定程度上加速中藥上市進度。
第三方醫藥服務體系麥斯康萊創始人史立臣對《每日經濟新聞》記者表示,這對有效性和安全性有保障的中藥帶來利好。一直以來,我國中醫藥發展面臨循證醫學證據匱乏、符合中醫特點評價體系缺失等問題,而真實世界證據可加快中藥新藥注冊的臨床研究。
值得注意的是,《指導原則》提出,任何以藥品注冊為目的對于真實世界證據的使用,都需要與審評機構進行充分的溝通交流,以確保雙方對使用真實世界證據的策略以及真實世界研究設計方案等方面達成共識。有專家認為,此舉能夠鼓勵已上市的中藥開展真實世界研究,從而促進上市后的中藥再評價,把可能被夸大的適應癥和不好的藥篩查出來,促進中醫藥行業良性發展。
在真實世界證據支持藥物研發與審評的同時,在業內看來,還需加強其數據的獲取與應用。真實世界數據的收集在全球范圍內都面臨著數據的質量、數據編碼的差異問題、院外的數據收集等挑戰。
上述行業分析人士表示,我國也存在患者數據收集的全面性以及信息化程度問題。“需要能夠拿到大量的患者全方位數據,而非僅是病例數據。另外,在數據的處理與應用上,都需要加快探索步伐。”
相關文章
藥品審評體系將生變,中國正發力在這一新領域補足短板
真實世界證據可用于支持藥物監管決策,包括為新藥注冊上市提供有效性和安全性證據、為已上市藥物的說明書變更提供證據、為藥物上市后要求或
上月生豬出欄環比大增14%,前期壓欄肥豬陸續集中上市
2020-01-08 17:38:31從當前生豬生產供應看,一些養豬場戶前期壓欄的肥豬,開始集中出欄上市。據監測,剛剛過去的2019年12月份,生豬出欄比
有的銷售占比過半 有的僅拿50萬元訂單 多家上市公司回應“特斯拉概念”
旭升股份稱,截至目前,特斯拉為公司第一大客戶,公司存在單一客戶依賴的風險;截至2019年半年度,公司對特斯拉銷售收入占主營業務收入的比
史上最嚴!農民工工資條例5月施行,逾期不付必追刑責
郭晉暉《條例》規定,逾期不支付的,向勞動者加付應付金額50%以上、100%以下的賠償金;涉嫌構成拒不支付勞動報酬罪的,及時移送司法機關追究
新年首場聚焦中小企業 資金融委30多天開了5場會!
杜川從2019年11月28日至1月7日,39天中金融委密集召開了5次會議。繼國務院支持民企改革發展28條新政重磅落地后,國務院金融穩定發展委員會
伊朗革命衛隊證實,美伊沖突,發射導彈襲擊美國駐伊拉克軍事基地
據伊朗媒體8日報道,伊朗伊斯蘭革命衛隊已向駐有美軍的伊拉克阿薩德空軍基地發射了數十枚導彈。據伊朗媒體8日報道,伊朗伊斯蘭革命衛隊已向
美參議院多數黨領袖麥康內爾稱有足夠票數推進彈劾
目前參議院正在等待眾議長佩洛西提交彈劾文件。佩洛西預計在當地時間周二下午與黨內人士開會討論。據美聯社報道,當地時間周二下午,美國會
魔性生長,潮玩制造者們忙著養成設計師生意紅到海外
陸瑤在這個爆發式增長的行業,設計師會成為明星。在上海徐家匯商圈的泡泡瑪特門店入口,一個年輕男孩正在認真地搖晃DIMOO的午夜馬戲團系列